Ρευματοειδής αρθρίτιδα: παθογενετικοί μηχανισμοί και θεραπευτική προσέγγιση
Η ρευματοειδής αρθρίτιδα (Ρ.Α.) είναι μία χρόνια αυτοάνοση φλεγμονώδης νόσος που χαρακτηρίζεται κυρίως από φλεγμονή και καταστροφή των αρθρώσεων σε συνδυασμό με ορολογικά ευρήματα αυτοανοσίας.
Γράφει ο
Ιωάννης Τασιούλας
Ρευματολόγος
Συνεργάτης ΥΓΕΙΑ
Νοέμβριος 2010
Αν και η αιτιολογία της Ρ.Α. δεν είναι γνωστή, η καλύτερη κατανόηση του μηχανισμού της χρόνιας φλεγμονής, που είναι και τελικά υπεύθυνη για την ιστική καταστροφή στη Ρ.Α., οδήγησε κατά την τελευταία δεκαετία στην ανάπτυξη νέων, στοχευμένων και πιο αποτελεσματικών θεραπειών. Σημαντική πρόοδος επίσης σημειώθηκε στην αναγνώριση γονιδίων που προδιαθέτουν στην ανάπτυξη της ρευματοειδούς αρθρίτιδας, τα οποία μπορεί στο άμεσο μέλλον να χρησιμοποιηθούν στην κλινική πράξη για διαγνωστικούς – προγνωστικούς σκοπούς ή/και να οδηγήσουν στην ανάπτυξη νέων, περισσότερο αποτελεσματικών και ασφαλέστερων θεραπευτικών προσεγγίσεων για την αντιμετώπιση της Ρ.Α.
Αιτία και παθογένεια της ρευματοειδούς αρθρίτιδας
Αν και το αίτιο της Ρ.Α. δεν είναι γνωστό, η σύγχρονη αντίληψη είναι ότι αποτελεί μία πολύπλοκη, γενετικά καθοριζόμενη νόσο. Αυτό σημαίνει ότι ένας συνδυασμός γονιδίων και περιβαλλοντικών παραγόντων οδηγεί στην εμφάνιση της χαρακτηριστικής παθολογίας αυτής. Μελέτες σε διδύμους έχουν δείξει ότι η συμμετοχή γενετικών παραγόντων ευθύνεται για το 50% του κινδύνου στην ανάπτυξη του συνδρόμου της Ρ.Α. Γονίδια που συνδέονται με αυξημένο κίνδυνο εκδήλωσης Ρ.Α. είναι ορισμένα αλληλόμορφα γονίδια του μείζονος συστήματος ιστοσυμβατότητας, όπως το HLA-DRB1, τα οποία παίζουν κεντρικό ρόλο στην παρουσίαση αντιγονικών πεπτιδίων στα Τ λεμφοκύτταρα, καθώς και γονίδια που κωδικοποιούν πρωτεΐνες με κεντρικό ρόλο στη λειτουργία και ρύθμιση του ανοσολογικού συστήματος, όπως τα PTPN22, TRAF1, C5, STAT4, IRF5. Μία σημαντική πρόοδος που έχει σημειωθεί τα τελευταία χρόνια είναι η ταυτοποίηση ειδικών για τη νόσο αυτοαντισωμάτων έναντι κυκλικού κιτρουλινοποιημένου πεπτιδίου (anti-CCP) ως διαγνωστικών αλλά και προγνωστικών δεικτών. Τα αντισώματα αυτά έχουν ευαισθησία για τη Ρ.Α. παρόμοια με αυτήν του ρευματοειδούς παράγοντα (65% – 75%), αλλά πολύ μεγάλη ειδικότητα (96% – 98%) για τη νόσο. Από τους περιβαλλοντικούς παράγοντες που συνδέονται με την εμφάνιση της Ρ.Α. ο πιο σημαντικός μέχρι στιγμής είναι το κάπνισμα. Άλλοι περιβαλλοντικοί παράγοντες κινδύνου για την ανάπτυξη Ρ.Α. είναι τα μεταλλικά έλαια και οι ίνες πυριτίου. Είναι χαρακτηριστικό ότι το κάπνισμα αποτελεί παράγοντα κινδύνου για τη Ρ.Α. που χαρακτηρίζεται από θετικό ρευματοειδή παράγοντα και anti-CCP αντισώματα.
Αντιγόνα που συνδέονται με την εμφάνιση της αρθρίτιδας παρουσιάζονται από αντιγονοπαρουσιαστικά κύτταρα, όπως δενδριτικά κύτταρα, μακροφάγα ή ενεργοποιημένα Β λεμφοκύτταρα σε ειδικά Τ λεμφοκύτταρα, τα οποία και ενεργοποιούνται. Η ενεργοποίηση των Τ λεμφοκυττάρων από το ειδικό γι? αυτά αντιγόνο απαιτεί και ένα δεύτερο ερέθισμα, το οποίο και παρέχεται σε αυτά με τα συνδιεγερτικά μόρια CD80 και CD86 που βρίσκονται στην επιφάνεια των αντιγονοπαρουσιαστικών κυττάρων. Τα μόρια αυτά συνδέονται με το μόριο CD28 στην επιφάνεια των Τ κυττάρων και οδηγούν στην πλήρη ενεργοποίησή τους. Στην πλειονότητά τους τα Τ λεμφοκύτταρα που βρίσκονται στον αρθρικό υμένα είναι ενεργοποιημένα και εκκρίνουν κυτταροκίνες, όπως ιντερλευκίνη-2 (IL-2) και ιντερφερόνη γ (IFNγ), οι οποίες και οδηγούν σε ενεργοποίηση μακροφάγων, Β λεμφοκυττάρων, ινοβλαστών και οστεοκλαστών. Τα Β λεμφοκύτταρα διαφοροποιούνται σε πλασματοκύτταρα, τα οποία και εκκρίνουν αυτοαντισώματα έναντι ανοσοσφαιρίνης γ (IgG) (ρευματοειδής παράγοντας), κιτρουλινοποιημένων πεπτιδίων (anti-CCP), ινωδογόνου, βιμεντίνης ή του αντιγόνου της ρευματοειδούς αρθρίτιδας 33kDa (RA33). Τα αυτοαντισώματα αυτά μετά την αναγνώριση και πρόσδεση του ειδικού αντιγόνου σχηματίζουν ανοσοσυμπλέγματα, τα οποία με τη σειρά τους ενισχύουν την παραγωγή φλεγμονωδών κυτταροκινών, όπως ο TNF, μέσω της ενεργοποίησης του συμπληρώματος και των υποδοχέων της ανοσοσφαιρίνης Fc (FcγR). Τα ενεργοποιημένα Β λεμφοκύτταρα αποκτούν και ρόλο αντιγονοπαρουσιαστικών κυττάρων ενεργοποιώντας έτσι και άλλα Τ λεμφοκύτταρα που εισέρχονται στον αρθρικό υμένα. Με αυτόν το μηχανισμό δημιουργείται ένας φαύλος κύκλος ενίσχυσης της αυτοάνοσης αντίδρασης στη ρευματοειδή αρθρίτιδα.
Στον αρθρικό υμένα των ασθενών με Ρ.Α., εκτός από τα κύτταρα της ειδικής (Τ και Β λεμφοκύτταρα) και μη ειδικής ανοσίας (δενδριτικά, μακροφάγα, πολυμορφοπύρηνα ουδετερόφιλα κύτταρα), ενεργοποιούνται και άλλοι κυτταρικοί πληθυσμοί, όπως ενδοθηλιακά κύτταρα των αγγείων, ινοβλάστες του αρθρικού υμένα και οστεοκλάστες.
Οι ινοβλάστες του αρθρικού υμένα πολλαπλασιάζονται και παράγουν κυτταροκίνες, προσταγλανδίνες και πρωτεολυτικά ένζυμα, όπως οι διάφορες μεταλλοπρωτεϊνάσες (matrix metalloproteinases, MMPs), που οδηγούν σε καταστροφή του χόνδρου και εισβολή του νεοσχηματιζόμενου φλεγμονώδους ιστού στο υποκείμενο οστό. Οι διαβρώσεις που σχηματίζονται στο υποκείμενο οστό οφείλονται στη διαφοροποίηση και ενεργοποίηση των οστεοκλαστών μέσω της παραγωγής ενζύμων, όπως η καθεψίνη Κ, που αποδομεί τον οστίτη ιστό. Οι οστεοκλάστες είναι κύτταρα που προέρχονται από μακροφάγα κύτταρα, τα οποία διαφοροποιούνται σε οστεοκλάστες στον αρθρικό υμένα. Κεντρικό ρόλο στη διαφοροποίηση των μακροφάγων κυττάρων σε οστεοκλάστες έχει το σύστημα RANK, RANKL (osteoprotegerin).
Πολλές κυτταροκίνες ενεργοποιούνται στον αρθρικό υμένα και εκκρίνονται από τα φλεγμονώδη κύτταρα που συσσωρεύονται σ? αυτόν. Κεντρικό ρόλο κατέχουν οι κυτταροκίνες TNF, IL-1 και IL-6, οι οποίες εκκρίνονται κυρίως από ενεργοποιημένα μακροφάγα και έχουν κεντρικό ρόλο στη ρύθμιση της φλεγμονώδους αντίδρασης στον αρθρικό υμένα. Η εξουδετέρωση της δράσης τους με ειδικά μονοκλωνικά αντισώματα ή διαλυτούς υποδοχείς οδηγεί σε αποτελεσματικό έλεγχο της φλεγμονώδους αντίδρασης, υποστροφή της υπερπλασίας του αρθρικού υμένα και πρόληψη των οστικών διαβρώσεων στην πλειονότητα των ασθενών με ρευματοειδή αρθρίτιδα.
Από τα ανωτέρω γίνεται εύκολα αντιληπτή η πολυπλοκότητα της παθογένειας της ρευματοειδούς αρθρίτιδας. Στο σχήμα 1 παρουσιάζεται σχηματικά η αλληλουχία των γεγονότων που οδηγεί στην εκδήλωση του συνδρόμου της Ρ.Α. με τις διάφορες φάσεις που καταλήγουν τελικά στις κλινικές εκδηλώσεις.
Διάγνωση
Η Ρ.Α. στην τυπική της μορφή συνήθως δεν είναι δύσκολο να διαγνωσθεί, η δε διάγνωσή της είναι πρωταρχικής σημασίας να γίνεται έγκαιρα. Η Ρ.Α. προσβάλλει ποσοστό 0,67% των Ελλήνων, κυρίως στην παραγωγική φάση της ζωής τους. Κλινικές μελέτες έχουν δείξει ότι 1 στους 2 ασθενείς αναγκάζεται να εγκαταλείψει την εργασία του την πρώτη δεκαετία της νόσου. Πολλές μελέτες έχουν δείξει ότι η έγκαιρη διάγνωση και θεραπευτική παρέμβαση είναι οι πιο σημαντικοί παράγοντες για την αποτελεσματική αντιμετώπισή της και την πρόληψη μεταγενέστερων επιπλοκών. Η διάγνωση της Ρ.Α. είναι κλινική, με κύρια χαρακτηριστικά τη συμμετρική πολυαρθρίτιδα (πάνω από 5 αρθρώσεις) κυρίως των καρπών και των μικρών αρθρώσεων στα χέρια και στα πόδια, τη δυσκαμψία που διαρκεί για διάστημα μεγαλύτερο της μιας ώρας έπειτα από ύπνο ή παρατεταμένη ακινησία, σε συνδυασμό με εργαστηριακά ευρήματα ενδεικτικά φλεγμονής, όπως αυξημένη CRP ή/και ΤΚΕ, αναιμία χρόνιας νόσου και θρομβοκυττάρωση. Ο ρευματοειδής παράγοντας είναι θετικός στο 60% – 70% των ασθενών με Ρ.Α., αλλά στερείται ειδικότητα για τη νόσο. Η ανίχνευση των αντισωμάτων έναντι κυκλικών κιτρουλινοποιημένων πεπτιδίων (anti-CCP) και η εισαγωγή τους στην κλινική πράξη είναι μία σημαντική εξέλιξη της τελευταίας δεκαετίας, μιας και αυτά τα αυτοαντισώματα έχουν την ίδια ευαισθησία με το ρευματοειδή παράγοντα, αλλά έχουν πολύ μεγάλη ειδικότητα για τη Ρ.Α. (93% – 97%). Ας σημειωθεί ότι ποσοστό 10% – 20% των ασθενών με Ρ.Α. έχει θετικά (συνήθως σε χαμηλό τίτλο) αντιπυρηνικά αντισώματα. Η αρχική εκτίμηση του ασθενή με Ρ.Α. περιλαμβάνει επίσης έλεγχο για την εντόπιση πιθανών οστικών αλλοιώσεων και αυτό γίνεται με απλές ακτινογραφίες καρπού – χειρός και ποδιών. Οι υπέρηχοι ή/και η μαγνητική τομογραφία είναι πιο ευαίσθητες μέθοδοι για την αναγνώριση φλεγμονωδών αλλοιώσεων του περιαρθρικού οστού και του αρθρικού χόνδρου και αναμένεται να χρησιμοποιούνται όλο και περισσότερο στην κλινική πράξη στο μέλλον.
Θεραπεία
Η θεραπευτική προσέγγιση στη Ρ.Α. έχει μεταβληθεί ριζικά την τελευταία δεκαετία. Αυτό έγινε για τους παρακάτω λόγους:
- Αναγνώριση ότι η πρώιμη και αποτελεσματική καταστολή της φλεγμονής είναι πρωταρχικής σημασίας.
- Ειδικοί μηχανισμοί της φλεγμονώδους αντίδρασης είναι οι καλύτεροι και αποτελεσματικότεροι στόχοι.
- Η Ρ.Α. είναι μία δυναμική διαδικασία και οι στόχοι μπορεί να μεταβάλλονται ανάλογα με το στάδιο του νοσήματος.
Η στρατηγική της πρώιμης και σχολαστικά ελεγχόμενης θεραπείας στη Ρ.Α. έχει συνεισφέρει όσο και οι στοχευμένες θεραπείες στη βελτίωση της λειτουργικότητας και της υγείας γενικότερα των ασθενών με Ρ.Α.
Κατά τη διάρκεια της περασμένης δεκαετίας, πολλές κλινικές μελέτες έχουν δείξει ότι η πρώιμη και επιθετική θεραπεία με τροποποιητικά της νόσου αντιρευματικά φάρμακα (disease modifying anti-rheumatic drugs, DMARDs), όπως η μεθοτρεξάτη, η σουλφασαλαζίνη, η υδροξυχλωροκίνη, η λεφλουναμίδη και τα γλυκοκορτικοειδή, είναι πολύ αποτελεσματική για τον έλεγχο της φλεγμονώδους δραστηριότητας και την πρόληψη της ανάπτυξης οστικών διαβρώσεων σε πολλούς ασθενείς με Ρ.Α. Εξίσου σημαντικές με την πρώιμη και επιθετική θεραπεία είναι η στενή κλινική παρακολούθηση των ασθενών και η γρήγορη τροποποίηση της θεραπευτικής αγωγής με σκοπό τον έλεγχο της νόσου. Μία πολύ σημαντική παράμετρος για την αποτελεσματική θεραπεία της Ρ.Α. είναι η εκτίμηση της ενεργότητας της νόσου με αντικειμενικούς δείκτες. Ένα χρήσιμο εργαλείο στην κλινική πράξη είναι ο υπολογισμός του δείκτη ενεργότητας της Ρ.Α. (disease activity score 28, DAS28) που βασίζεται σε συνδυασμό κλινικών και εργαστηριακών δεδομένων (αριθμός διογκωμένων και ευαίσθητων αρθρώσεων, ΤΚΕ, κλίμακα πόνου ασθενούς) και συσχετίζεται σε μεγάλο βαθμό με την κλινική κατάσταση του ασθενή. Ο δείκτης αυτός έχει αποδειχθεί σε κλινικές μελέτες ότι αποτελεί ένα αξιόπιστο εργαλείο για τη λήψη αποφάσεων έναρξης ή/και μεταβολής της θεραπείας ασθενών με Ρ.Α.
Η ανάπτυξη στοχευμένων θεραπειών έναντι μορίων που έχουν κεντρικό ρόλο στην παθογένεια της Ρ.Α. είναι ένα σημαντικό βήμα για τη θεραπεία της. Οι στοχευμένες θεραπείες έχουν μεταβάλει τη φυσική ιστορία της νόσου, τη ζωή των ασθενών και την πρακτική των ρευματολόγων την τελευταία δεκαετία. Βάση γι? αυτήν την πρόοδο στη θεραπευτική προσέγγιση της Ρ.Α. αποτελεί η καλύτερη κατανόηση των παθογενετικών μηχανισμών της Ρ.Α. Η πρώτη σημαντική ανακάλυψη ήταν η αναγνώριση της κυτταροκίνης TNF ως κεντρικού παράγοντα της φλεγμονώδους αντίδρασης στον αρθρικό υμένα ασθενών με Ρ.Α. Αυτήν τη στιγμή υπάρχουν διαθέσιμοι για κλινική χρήση πέντε τέτοιοι παράγοντες: infliximab (Remicade), etanercept (Enbrel), adalimumab (Humira), certolizumab (Cimzia) και golimumab (Simponi). Πολλές κλινικές μελέτες έχουν δείξει ότι ο συνδυασμός των παραπάνω παραγόντων με μεθοτρεξάτη είναι πολύ αποτελεσματικός όχι μόνο για τον έλεγχο της φλεγμονής, αλλά και για την πρόληψη των οστικών διαβρώσεων που οδηγούν τελικά σε δυσλειτουργία και σε καταστροφή των αρθρώσεων. Η θεραπευτική επιτυχία των anti-TNF παραγόντων οδήγησε στην ανάπτυξη και άλλων παραγόντων που στοχεύουν διαφορετικούς μεσολαβητές της φλεγμονώδους αντίδρασης ή τα κύτταρα που τους παράγουν. Οι παράγοντες αυτοί στοχεύουν την IL-1 [anakinra, (Kineret)], τον κυτταρικό υποδοχέα της IL-6 [tocilizumab, (Roactemra)], την ενεργοποίηση των Τ λεμφοκυττάρων από αντιγονοπαρουσιαστικά κύτταρα [CTLA4-Ig, abatacept, (Orencia)] και τα Β λεμφοκύτταρα [rituximab, (Mabthera)].
Η σημερινή προσέγγιση για τη θεραπεία της Ρ.Α., όπως έχει διαμορφωθεί από τα αποτελέσματα των κλινικών μελετών, είναι η παρακάτω: έναρξη της θεραπείας με μεθοτρεξάτη, και σε μερικές περιπτώσεις χαμηλές δόσεις γλυκοκορτικοειδών, και προσθήκη ενός anti-TNF παράγοντα σε 2 – 3 μήνες αν δεν έχουν επιτευχθεί οι θεραπευτικοί στόχοι. Για τους ασθενείς που δεν θα αποκριθούν θετικά στον συνδυασμό μεθοτρεξάτης και anti-TNF παράγοντα έπειτα από 6 – 8 μήνες γίνεται αντικατάσταση του anti-TNF παράγοντα είτε με abatacept (CTLA4-Ig), είτε με rituximab (anti-CD20), είτε με tocilizumab (anti-IL6R). Συγκριτικά με το συνδυασμό των κλασικών τροποποιητικών της νόσου φαρμάκων (DMARDs), ο συνδυασμός των στοχευμένων θεραπειών με DMARDs εξασφαλίζει ταχύτερο και αποτελεσματικότερο έλεγχο της νόσου, υψηλότερα ποσοστά παραμονής στη θεραπεία και αποτελεσματικότερη προστασία των αρθρώσεων.
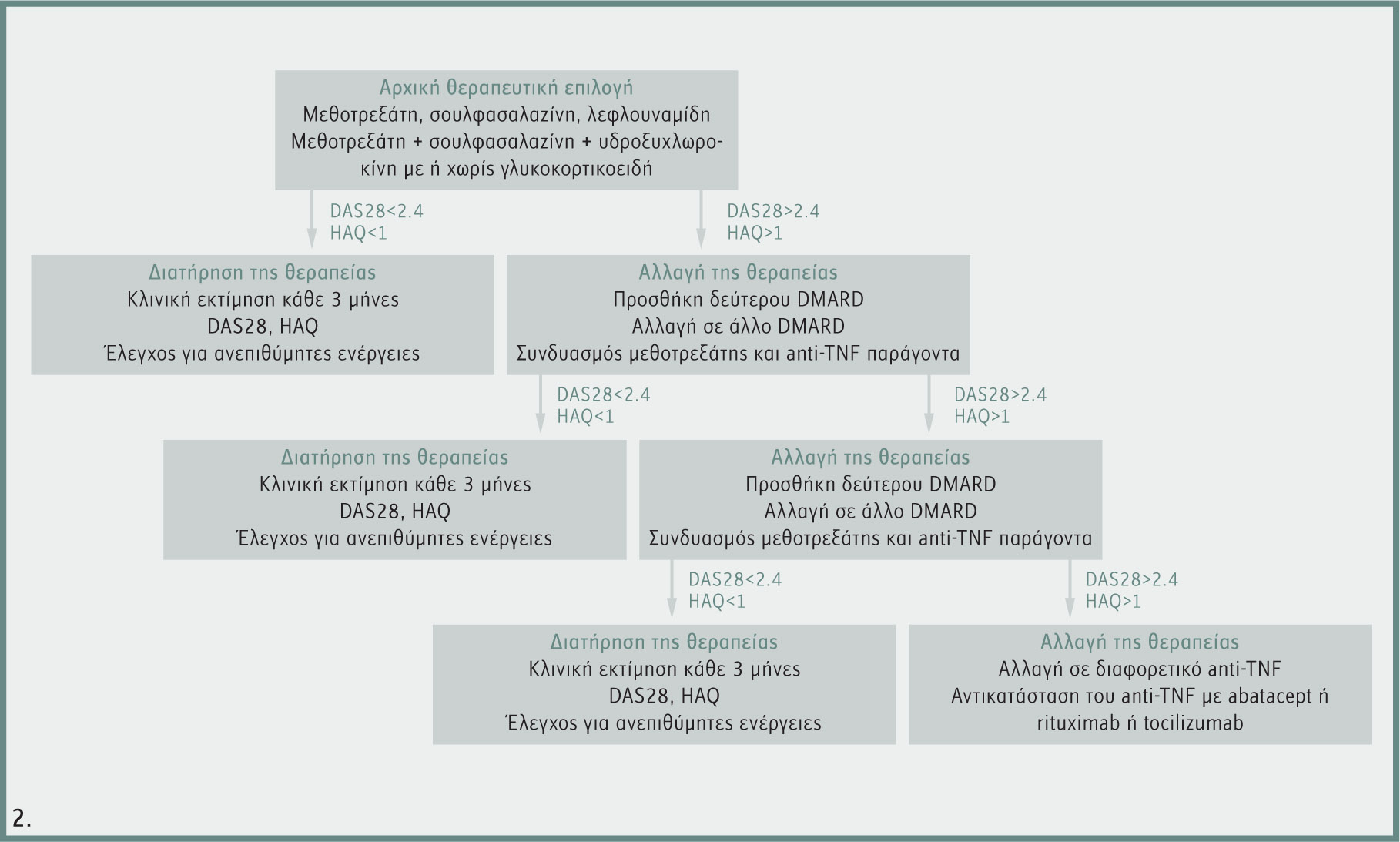
Η χρήση των στοχευμένων θεραπειών, αν και είναι αποτελεσματική για τον έλεγχο της νόσου, δεν είναι απαλλαγμένη από παρενέργειες. Έτσι, η χρήση των anti-TNF παραγόντων συνοδεύεται από αυξημένο κίνδυνο ανάπτυξης λοιμώξεων και ειδικότερα φυματίωσης. Αυτό έχει ως αποτέλεσμα τον έλεγχο για τυχόν ύπαρξη φυματίωσης σε όλους τους ασθενείς πριν από την έναρξη της θεραπείας και τη στενή παρακολούθησή τους κατά τη διάρκειά της για την εμφάνιση συμπτωμάτων ύποπτων για λοίμωξη. Κακοήθειες και ειδικότερα η ανάπτυξη λεμφώματος είναι άλλες πιθανές παρενέργειες. Μέχρι στιγμής, δέκα και πλέον χρόνια μετά την εισαγωγή των anti-TNF παραγόντων στην κλινική πράξη, ο κίνδυνος ανάπτυξης κακοηθειών, είτε συμπαγών οργάνων είτε λεμφωμάτων, δε φαίνεται να είναι αυξημένος στους ασθενείς αυτούς. Ένας αλγόριθμος για τη σύγχρονη θεραπεία της ρευματοειδούς αρθρίτιδας που βασίζεται σε κλινικές μελέτες φαίνεται στο σχήμα 2.
Παρά την ύπαρξη και την ανάπτυξη όλων αυτών των νεότερων στοχευμένων θεραπειών, υπάρχουν ακόμη ασθενείς που δεν αποκρίνονται στη θεραπεία, και μακροχρόνια ύφεση της νόσου χωρίς τη χρήση φαρμάκων επιτυγχάνεται μόνο σε λίγους ασθενείς με Ρ.Α. Η τοξικότητα και οι παρενέργειες των φαρμάκων δεν είναι αμελητέες και η επούλωση ήδη σχηματισμένων οστικών βλαβών δεν είναι εφικτή με τις υπάρχουσες θεραπευτικές προσεγγίσεις. Η καλύτερη κατανόηση των υπεύθυνων γενετικών παραγόντων και των παθογενετικών μηχανισμών της ρευματοειδούς αρθρίτιδας είναι βέβαιο ότι θα οδηγήσει σε πιο αποτελεσματικές και ασφαλέστερες θεραπευτικές προσεγγίσεις στο όχι πολύ απώτερο μέλλον.
Abstract
Tassioulas I. Rheumatoid arthritis: Pathogenetic mechanisms and medical approach. Iatrika Analekta 2010, 3:291-295
Rheumatoid arthritis is a systemic, inflammatory, autoimmune disease that affects predominantly the joints. Enhanced understanding of molecular pathogenesis has enabled development of innovative biological agents that target specific parts of the immune system. Pro-inflammatory cytokines such as interleukin-1, interleukin-6 and tumor necrosis factor (TNF) are major mediators of the disease. Highly specific anti-cyclic citrullinated peptide (anti-CCP) antibodies may be used for early diagnosis in atypical disease presentations and to predict the outcome. Extra-articular manifestations should be recognized early and be treated aggressively. New therapeutic strategies that promote early use of disease modifying drugs with tight disease control and distinct and quantifiable treatment goals, prevents future complications and improves prognosis. Today such approaches can halt most cases of joint destruction but not all instances of joint inflammation and comorbidity. Understanding the cause(s) and pathogenesis of different rheumatoid arthritis subsets will lead not only to individualized treatments during early phases of the illness but also to disease prevention.
Bιβλιογραφία
- Tassiulas I, Paget SA. Rheumatoid Arthritis. In: Manual of Rheumatology and Outpatient Orthopedic Disorders. (5th Edit.), Lippincott Williams & Wilkins, Philadelphia, PA 2006; 206 – 220.
- Klareskog L, Catrina AI, Paget SA. Rheumatoid Arthritis. Lancet 2009; 373:659 – 672.
- van Vollenhoven RF. Treatment of Rheumatoid Arthritis: State of the Art 2009. Nat. Rev. Rheumatol. 2009; 5:531 – 541.
- Feldmann M, Taylor PC. Anti-TNF Biologic Agents: Still the Therapy of Choice for Rheumatoid Arthritis. Nat. Rev. Rheumatol. 2009; 5:578 – 582.
- McInnes IB, Schett G. Cytokines in the Pathogenesis of Rheumatoid Arthritis. Nat. Rev. Immunol. 2007; 7: 429-442.

Σχήμα 1. Στάδια παθογένεσης της ρευματοειδούς αρθρίτιδας. Με βάση πειραματικά δεδομένα, η αυτοάνοση διαταραχή που χαρακτηρίζει τη ρευματοειδή αρθρίτιδα αρχίζει χρόνια πριν από την κλινική εκδήλωση της νόσου. Στη συνέχεια υπάρχει μία μεταβατική φάση κατά την οποία κάποιος εκλυτικός παράγοντας οδηγεί στην τελευταία αρθριτική φάση, η οποία χαρακτηρίζεται από την κλινική εκδήλωση της αρθρίτιδας. Μετά την κλινική εκδήλωση της ρευματοειδούς αρθρίτιδας, οι μηχανισμοί της φλεγμονής φαίνεται ότι παίζουν τον κύριο ρόλο και οδηγούν στην καταστροφή των αρθρώσεων και στην ανάπτυξη οστεοπόρωσης και καρδιαγγειακών διαταραχών.