Η βιοψία του λεμφαδένα φρουρού στον καρκίνο του μαστού: τεχνική και κλινική σημασία
Στους συμπαγείς όγκους που μεθίστανται κατ? αρχάς λεμφογενώς, όπως ο καρκίνος του μαστού και το μελάνωμα, έχει ιδιαίτερη προγνωστική αξία η κατάσταση των λεμφαδένων της περιοχικής ομάδας.
Γράφει ο
Δημήτρης-Ανδρέας Τσιφτσής
Χειρουργός
Διευθυντής E΄ Χειρουργικής Κλινικής ΥΓΕΙΑ
Στην περίπτωση του καρκίνου του μαστού περιοχικοί είναι κατά κύριο λόγο οι λεμφαδένες της σύστοιχης μασχαλιαίας κοιλότητας και δευτερευόντως αυτοί της έσω μαστικής αλύσου. Ως λεμφαδένας φρουρός (ΛΦ) ορίζεται αυτός που πρώτος υποδέχεται τη λέμφο από την προσβεβλημένη περιοχή του μαστού, άρα και τα καρκινικά κύτταρα όταν αποσπαστούν από τον όγκο (εικόνα 1).

Η παραδοχή αυτή προϋποθέτει την κατά την ανατομική τάξη μετακίνηση των καρκινικών κυττάρων από την πρωτοπαθή εστία στα λεμφαγγεία και μέσω αυτών στο ΛΦ και από αυτόν σε άλλους λεμφαδένες υψηλοτέρου επιπέδου. Εάν ο ΛΦ παρακαμφθεί με εγκατάσταση των μεταστάσεων σε υψηλότερους λεμφαδένες, τότε υπάρχει η κατά άλματα μετάσταση (skip metastasis), που παρατηρείται στο 4% περίπου των περιπτώσεων.
Αναφορές στην έννοια του ΛΦ ως σύστοιχου λεμφαδένα υπάρχουν από τον Virchof στον καρκίνο του στομάχου, αλλά η σύγχρονη επιστημονική τεκμηρίωσή του γίνεται το 1992 στο μελάνωμα από τον Morton στο John Wane Cancer Center με τη χρήση κυανής χρωστικής για τη χαρτογράφηση της απαγωγού λεμφικής οδού και την ανάδειξη του ΛΦ. Το 1994, στο ίδιο κέντρο, ο Giuliano εφαρμόζει την τεχνική στον καρκίνο του μαστού. Στη χώρα μας εφαρμόστηκε για πρώτη φορά το 1995 στην Κλινική της Χειρουργικής Ογκολογίας του Πανεπιστημίου Κρήτης, όπου δημιουργήθηκε και η μεγαλύτερη σειρά.
Βασίζεται στη χαρτογράφηση της απαγωγού λεμφικής οδού από την πρωτοπαθή εστία μέχρι το λεμφαδένα υποδοχής στη μασχαλιαία κοιλότητα ή σπανιότατα στην έσω μαστική. Οι ουσίες που χρησιμοποιούνται ως ιχνηθέτες είναι:
- Κυανές χρωστικές, όπως το isosulfan blue, patent blue V και blue de methylene. Την ώρα της εγχείρησης ενίονται 3-5 ml και η αναζήτηση του ΛΦ αρχίζει 5-7 min αργότερα, ανάλογα με τη θέση της ένεσης. Είναι φθηνές και ευρέως διαθέσιμες. Έχουν ισχυρή χρωστική ικανότητα και, αν ενεθούν ενδοδερμικά, η χρώση παραμένει για 2-3 χρόνια. Απεκκρίνονται διά των ούρων, τα οποία χρωματίζουν, και μπορεί να δεσμεύσουν παροδικώς την Hb με επακόλουθη πτώση της περιφερικής οξυμετρίας.
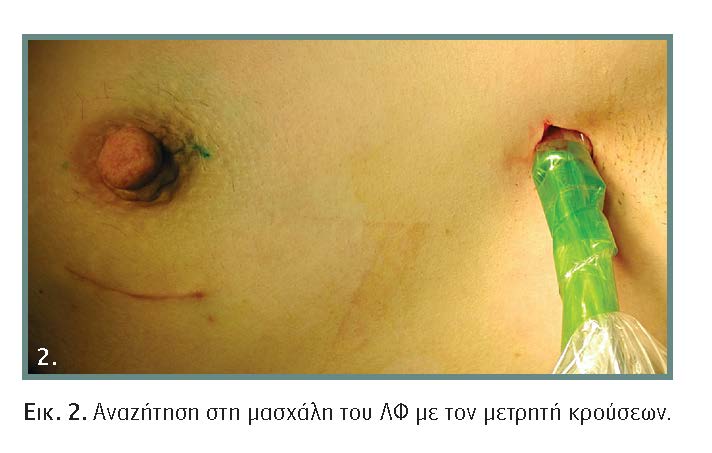
- Ραδιοϊσοτοπικά συμπλέγματα, κυρίως του Tc99m με κολλοειδείς ουσίες (sulfur colloid, nanocolloid και antimony sulfide). Προϋποθέτει την ύπαρξη συγκροτημένου τμήματος πυρηνικής ιατρικής. Η ένεση του ισοτόπου μπορεί να γίνει από λίγες ώρες πριν από το χειρουργείο μέχρι το προηγούμενο της επέμβασης απόγευμα. Η ταχύτητα απαγωγής του ιχνηθέτη για την ανάδειξη του ΛΦ εξαρτάται από τη διάμετρο των μικκυλίων του κολλοειδούς, τον ενιέμενο όγκο και τη θέση της ένεσης. Στον καρκίνο του μαστού, σε αντίθεση με το μελάνωμα, δεν κρίνεται απαραίτητη η προεγχειρητική λεμφαγγειογραφία με γ-camera, γιατί η λεμφική οδός είναι περισσότερο προβλέψιμη. Η αναζήτηση του ΛΦ στο χειρουργείο γίνεται με φορητό ανιχνευτή γ ακτινοβολίας (εικόνα 2), με τον οποίο εντοπίζεται στη μασχάλη in vivo η θέση μέγιστων κρούσεων (counts/sec). Η τεχνική αυτή απαιτεί ειδικό εξοπλισμό, τη συνεργασία διαφορετικών ειδικοτήτων, έχει σημαντικά υψηλότερο κόστος και οργανωτικές απαιτήσεις.
Η θέση της ένεσης του ιχνηθέτη ποικίλλει χωρίς σημαντικές διαφορές στην ανάδειξη του ΛΦ. Συνήθως γίνεται υποθηλαίως (εικόνα 3) προς την πλευρά του όγκου, ενδοδερμικώς ύπερθεν του όγκου ή πέριξ του όγκου, μέσα στο παρέγχυμα του μαστού. Ποτέ εντός του όγκου, γιατί στερείται λεμφαγγεία και θα πρέπει η ουσία να βγει στην επιφάνεια του όγκου για να προσληφθεί από τα λεμφαγγεία του ξενιστή.
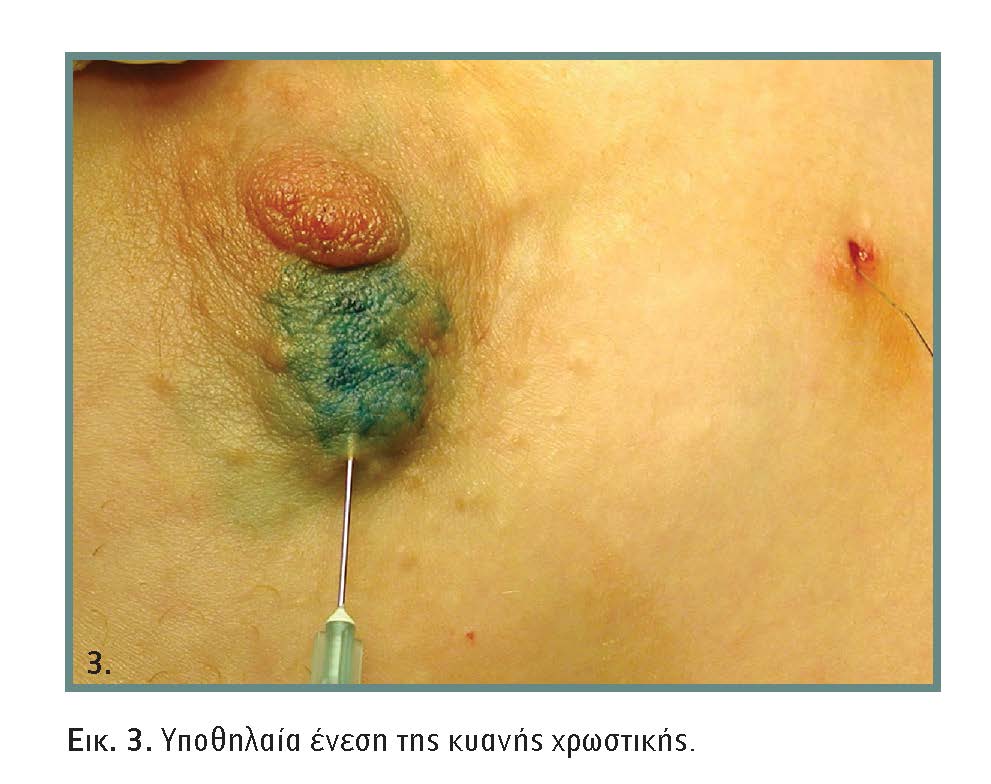
Προτιμάται πάντως η υποθηλαία, γιατί έχει ταχύτερη απαγωγή, μικρότερη χρώση του δέρματος και προκειμένου για ραδιοφάρμακο αποφεύγεται το φαινόμενο του shine through προς τη μασχάλη, αν ο όγκος εντοπίζεται στο άνω-έξω τεταρτημόριο του μαστού.
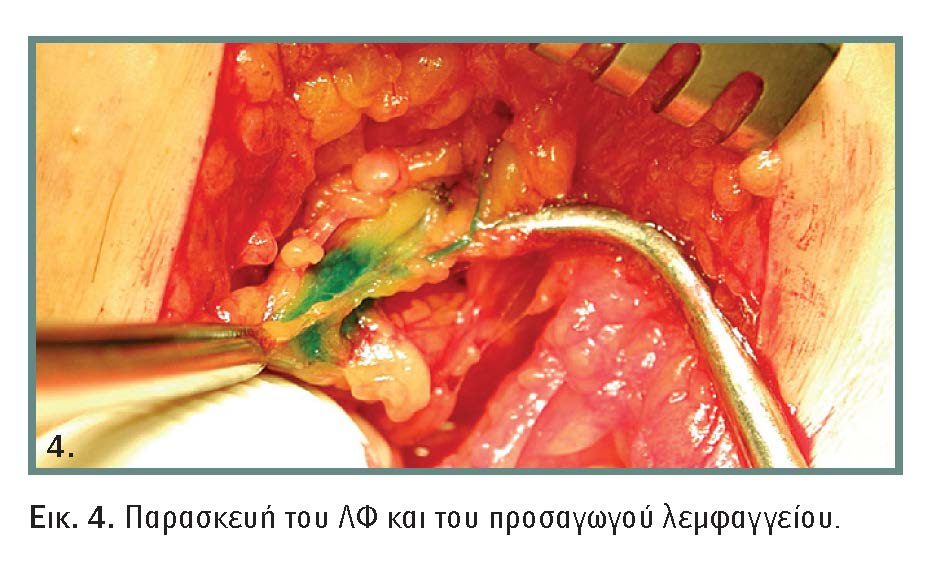
Η αναζήτηση του ΛΦ στη μασχάλη γίνεται με μικρή εγκάρσια τομή στο άκρο του τριχωτού προς το μαστό ή πάνω από το σημείο των μέγιστων κρούσεων. Στην περίπτωση της χρωστικής, η παρασκευή πρέπει να είναι ιδιαίτερα επιμελής, γιατί η διατομή αγγείων μπορεί να χρωματίσει τους ιστούς και να κάνει τη διάκριση του ΛΦ δύσκολη. Αν αναγνωριστεί κυανός λεμφαδένας, πρέπει να παρασκευαστεί το προσαγωγό λεμφαγγείο προκειμένου να αποκλειστεί η ύπαρξη άλλου λεμφαδένα κεντρικότερα (εικόνα 4).
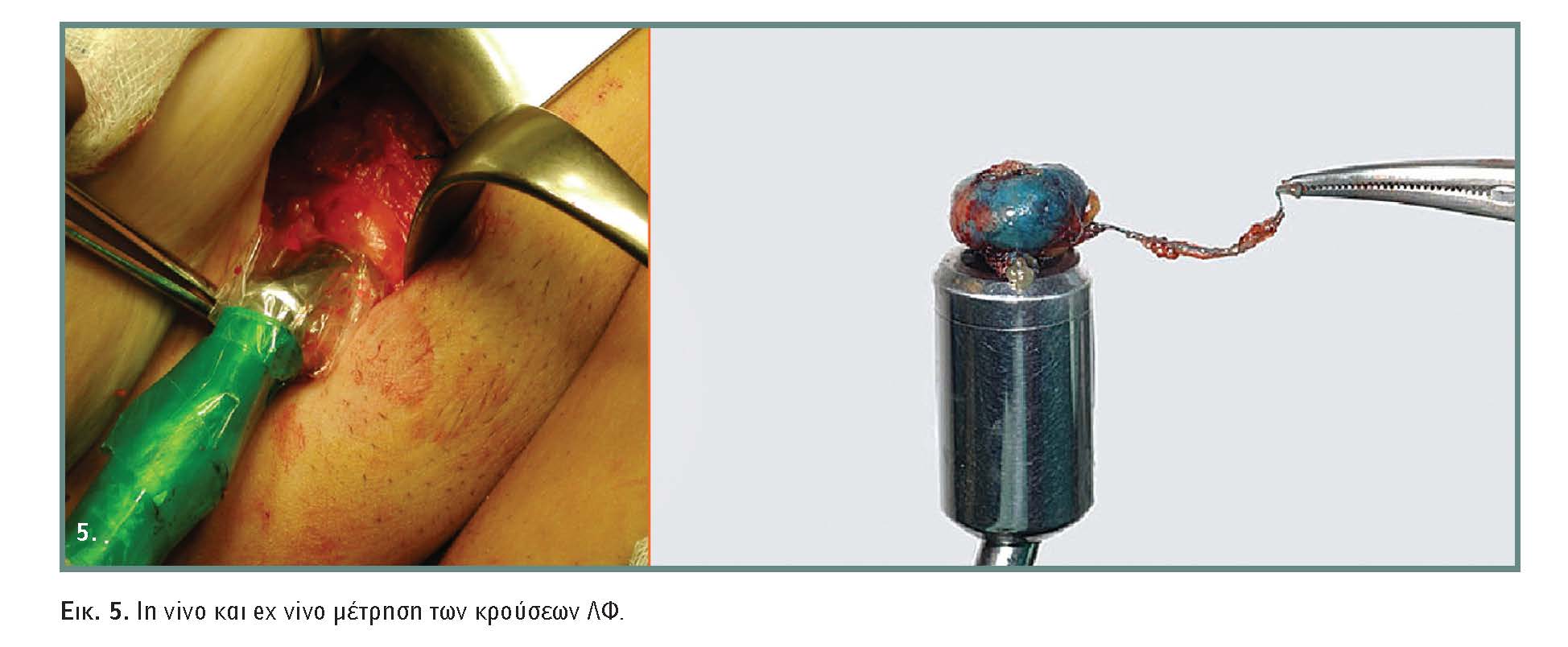
Μπορεί να επισημανθεί ένας ή περισσότεροι. Αφαιρούνται όλοι χωρίς να συνθλιβούν. Εάν έχει χορηγηθεί ισότοπο ο λεμφαδένας μετράται ex vivo (εικόνα 5), όπου οι κρούσεις πρέπει να είναι υψηλότερες απ? ό,τι in vivo. Η ακτινοβολία του υποστρώματος (background) πρέπει να είναι μικρότερη του 10% του ΛΦ, αλλιώς η αναζήτηση και άλλου ΛΦ συνεχίζεται. Περισσότερες τεχνικές λεπτομέρειες μπορούν να αναζητηθούν στα ειδικά άρθρα.
Αν είναι εφικτός, ο συνδυασμός των δύο τεχνικών είναι επιθυμητός γιατί έχει τα υψηλότερα ποσοστά επιτυχούς αναγνώρισης του ΛΦ, σε λιγότερο χρόνο με μικρότερη τομή. Το ζήτημα της ακτινοβόλησης της ασθενούς ή του προσωπικού είναι αμελητέο. Η συνήθης δόση είναι περίπου 37 MBq (1 mCi), με απόδοση στην ασθενή 30 MBq (0,8 mCi). Στις ΗΠΑ δεν υπάρχουν περιορισμοί στη σωματική επαφή για δόσεις μικρότερες των 1.110 MBq (30 mCI). Ένας χειρουργός θα πρέπει να κάνει 5.000 επεμβάσεις το χρόνο πριν φτάσει σ? αυτήν τη δόση ή 500 για να φορέσει μετρητή.
Η αξιολόγηση του χειρουργού ότι είναι επαρκής για την ταυτοποίηση του ΛΦ είναι το κρισιμότερο στοιχείο, δεδομένου ότι αυτό που θα χαρακτηρίσει ως ΛΦ θα καθορίσει τη θεραπεία της ασθενούς και άρα την επιβίωσή της. Αποδεκτή θεωρείται η επιτυχής εύρεση του ΛΦ στο 92%-95% των περιπτώσεων, με λιγότερα από 10% ψευδώς αρνητικά. Δυστυχώς οι περισσότεροι χειρουργοί, και όχι μόνο στη χώρα μας, αυτοαξιολογούνται όπως ειρωνικά αναφέρει ο Giuliano σε άρθρο του: see one, do one, teach one.
Κάθε χειρουργός πρέπει να εκτελέσει αριθμό επεμβάσεων υπό καθοδήγηση και στη συνέχεια να επαληθεύσει την πείρα που απέκτησε (validation phase) εκτελώντας ΛΦ και μασχαλιαίο λεμφαδενικό καθαρισμό (ΜΛΚ) στην ίδια ασθενή. Η επιβεβαίωση της πείρας γίνεται όταν ο ΛΦ είναι ο μόνος διηθημένος. Τότε μπορεί με ασφάλεια για τις ασθενείς του να υιοθετήσει την τεχνική του ΛΦ για τη σταδιοποίηση της μασχάλης. Το ζήτημα αυτό είναι περισσότερο σοβαρό απ? ό,τι ο τρόπος με τον οποίο αντιμετωπίζεται.
Στην ιστολογική εξέταση του ΛΦ, το γεγονός ότι ο ιστός προς εξέταση είναι λιγότερος του ΜΛΚ επιτρέπει λεπτομερέστερη μελέτη, με τεχνικές όπως η ανοσοϊστοχημεία (IHC), η PCR και ο in situ υβριδισμός. Σε υλικό προηγούμενων ΜΛΚ που εξετάστηκαν οι λεμφαδένες με τεχνικές ΛΦ, στο 28% των ασθενών βρέθηκαν μικρομεταστάσεις και το 15% άλλαξε στάδιο. Αν η τεχνική εφαρμοστεί lege artis από πιστοποιημένο χειρουργό, τότε μπορεί με ασφάλεια να αντικαταστήσει το ΜΛΚ για τη σταδιοποίηση της μασχάλης. Το ποσοστό υποτροπής στη μασχάλη με αρνητικό ΛΦ χωρίς επακόλουθο ΜΛΚ είναι 0-0,6%.
Αν η εξέταση του ΛΦ μπορεί να γίνει διεγχειρητικώς, τότε σε περίπτωση που βρεθεί διηθημένος και απαιτείται ΜΛΚ, αυτός μπορεί να γίνει στο ίδιο χειρουργείο και τον ίδιο χρόνο με την επέμβαση στο μαστό. Οι τεχνικές που χρησιμοποιούνται για την ταχεία εξέταση του ΛΦ, όπως η ταχεία με κρυοστάτη και H-E, οι διάφορες ανά εργαστήριο παραλλαγές εντυπωμάτων και οι ταχείες IHC, δεν είναι απόλυτα αξιόπιστες. Πρόσφατα η μοριακή τεχνική της OSNA (one-step nucleic acid amplification) υπόσχεται να αυξήσει την ακρίβεια και την ταχύτητα της διεγχειρητικής διάγνωσης.
Κλινική εφαρμογή
Η ευρύτατη εφαρμογή της τεχνικής του ΛΦ επέβαλε την αναθεώρηση της TNM σταδιοποίησης των λεμφαδένων της μασχάλης. Έτσι λεμφαδένες που φιλοξενούν μεμονωμένα καρκινικά κύτταρα ή συγκεντρώσεις κυττάρων με διάμετρο μικρότερη των 0,2 mm που αναδεικνύονται μόνο με IHC ή rtPCR, χαρακτηρίζονται αντίστοιχα Ν0(i+) και N0(mol+) (εικόνα 6).
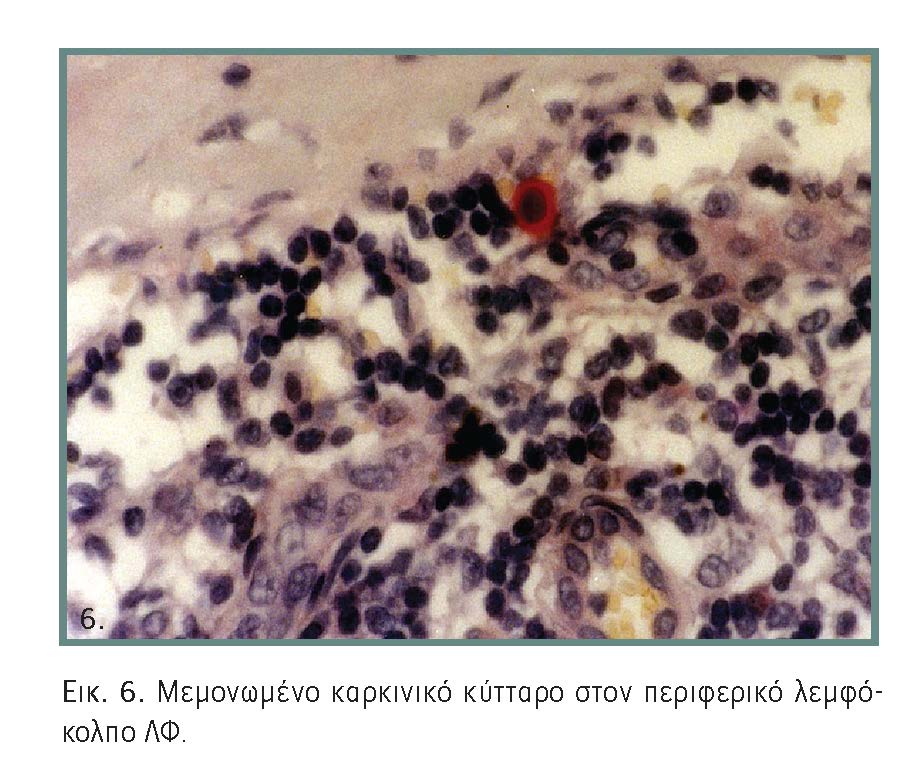
Εάν οι μεταστατικές εναποθέσεις είναι μεταξύ 0,2 και 2 mm χαρακτηρίζονται ως μικρομεταστάσεις και ταξινομούνται Ν1mi. Οι ενδομαζικοί λεμφαδένες δεν λαμβάνονται υπόψη στη σταδιοποίηση.
Ασθενής με ΛΦ αρνητικό αποφεύγει το ΜΛΚ. Σε ΛΦ διηθημένο η οδηγία των επιστημονικών ενώσεων είναι να ακολουθεί πάντα ΜΛΚ. Σήμερα ο καρκίνος του μαστού διαγιγνώσκεται σε πρωιμότερο στάδιο, συχνά με μη ψηλαφητούς όγκους.
Στο υλικό αυτών των γυναικών με διηθημένο ΛΦ, στο 1/3 των ασθενών που θα υποβληθούν σε ΜΛΚ ο ΛΦ θα είναι ο μόνος διηθημένος λεμφαδένας. Με αυτήν την παρατήρηση ως έναυσμα ξεκίνησαν προσπάθειες κατασκευής νομογράμματος, που με βάση τα χαρακτηριστικά της πρωτοπαθούς εστίας θα προβλέπει κατά πόσο μια ασθενής με διηθημένο ΛΦ έχει πιθανότητες αυτός να είναι ο μόνος διηθημένος και να αποφύγει έτσι την επιβάρυνση του ΜΛΚ.
Η τάση αυτή περιορισμού της χειρουργικής της μασχάλης, ακόμα και με διηθημένο ΛΦ, ενθαρρύνεται τόσο από τα ευρήματα παλαιοτέρων τυχαιοποιημένων μελετών (NSABP-B04) όπου το 50% των ασθενών με διηθημένους λεμφαδένες δεν εκδήλωσαν κλινικά σημεία, αλλά και πολύ νεότερων από σοβαρά κέντρα (MS-KCC), από τις οποίες φαίνεται πως σε 4.008 ασθενείς με θετικό ή αρνητικό ΛΦ που υποβλήθηκαν ή όχι σε ΜΛΚ, η υποτροπή στη μασχάλη σε όλες τις ομάδες ήταν 0,25% και 1,4% στις ασθενείς με θετικό ΛΦ χωρίς ΜΛΚ.
Φαίνεται ότι επέρχεται η εποχή της αναίμακτης σταδιοποίησης της μασχάλης με US και FNA ή με PET/CT και παρακολούθηση με μετάθεση της εγχείρησης όταν και αν η νόσος γίνει κλινικώς εμφανής. Να τονιστεί ωστόσο πως η μικροδιήθηση του ΛΦ επιβαρύνει την πρόγνωση, ειδικώς αν δε χορηγηθεί επικουρική θεραπεία, όπως και η τοπική υποτροπή στη μασχάλη.
Ενδείξεις – αντενδείξεις
Έχει απόλυτη ένδειξη σε κλινικώς Ν0 μασχάλη. Εντός πρωτοκόλλου και σε Ν1, γιατί ως γνωστόν στο 30% οι ψηλαφητοί λεμφαδένες δεν είναι και διηθημένοι.
Οι αντενδείξεις είναι σχετικές. Σε αμιγώς in situ πορογενές καρκίνωμα, ακόμη ίσως και μικροδιηθητικό, δεν ενδείκνυται. Εξαίρεση αποτελεί αν αντιμετωπίζεται με μαστεκτομή ή σε πολύ επιβαρυντικούς παράγοντες (διάγνωση με FNA, comedo, μέγεθος).
Σε πολυκεντρικό ή πολυεστιακό, το ποσοστό επιτυχούς εντόπισης είναι 96% με ψευδώς αρνητικά 7,7%.
Σε προεγχειρητική χημειοθεραπεία, αν η μασχάλη είναι κλινικά Ν0, μπορεί να γίνει πριν από τη ΧΜΘ. Αν είναι Ν1 ή Ν2, μπορεί να γίνει πριν από τη ΧΜΘ αναίμακτη σταδιοποίηση της μασχάλης με US και FNA και μετά τη ΧΜΘ με την επέμβαση στο μαστό να γίνει ΛΦ. Είναι γνωστό πως οι ασθενείς με θετική μασχάλη, που μετά τη ΧΜΘ γίνονται Ν0, έχουν καλύτερη επιβίωση. Άρα η πληροφορία αυτή είναι πολύ σημαντική. Η εφαρμογή της σε εγκύους δεν είναι απαγορευτική.
Η επιτυχία της τεχνικής δεν επηρεάζεται από προηγούμενη εγχείρηση στο μαστό ή τη μασχάλη. Εφαρμόζεται το ίδιο επιτυχώς στον ανδρικό μαστό. Οι επιπλοκές του ΛΦ είναι ασυγκρίτως λιγότερες και ηπιότερες του ΜΛΚ.
(Όλες οι εικόνες του άρθρου είναι από περιπτώσεις του συγγραφέα)
Bιβλιογραφία
1. Morton DL, Wen DR, Wong JH, et.al. Technical details of intraoperative lymphatic mapping of early stage melanoma. Arch Surg 1992; 127: 392-399.
2. Giuliano AE, Kirgan DM, Guenther JM, et.al. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg 1994; 220: 391-398.
3. Sanidas EE, Tsiftsis DD. Technical details for the sentinel node biopsy in breast cancer: A guide for the training process. Eur J Surg Oncol 2001; 27: 414-427.
4. Giuliano AE. See one, do twenty-five, teach one: The implementation of sentinel node dissection in breast cancer. Ann Surg Oncol 1999; 6: 520-521.
5. Sanidas E, de Bree E, Tsiftsis DD. How many cases are enough for accreditation in sentinel lymph node biopsy in breast cancer? Am J Surg 2003; 185: 202-210.
6. Sanidas E, Daskalakis M, Sbyrakis N, Tsiftsis D. Modifications of the learning curve guidelines for breast cancer sentinel node biopsy. Eur J Surg Oncol 2005; 31: 357-363.
7. Van la Para RF, Francissen CM, et al. Assessment of the Memorial Sloan-Kettering Cancer Center nomogram to predict sentinel lymph node metastases in a Dutch breast cancer population. Eur J Cancer 2013; 49: 564-571.
8. Naik AM, Fey J, Gemignani M, et al. The risk of axillary relapse after sentinel lymph node biopsy for breast cancer is comparable with that of axillary lymph node dissection: A follow-up study of 4.008 procedures. Ann Surg 2004; 240: 462-468.
9. Lee MC, Joh JE, Chau A. Axillary staging prior to neoadjuvant chemotherapy. The roles of sentinel lymph node biopsy and axillary ultrasonography. Cancer Control 2012; 19: 277-285.
Οκτώβριος 2016






































